Por Riccardo Neri — Um amplo rastreamento genômico com tecnologia CRISPR identificou centenas de novos genes essenciais ao desenvolvimento precoce das células cerebrais, incluindo o gene PEDS1, associado a um distúrbio neuroevolutivo grave ainda não descrito. O estudo, publicado em Nature Neuroscience, foi conduzido pelo Instituto de Ciências da Vida da Universidade Hebraica de Jerusalém, sob a coordenação de Sagiv Shifman e Binnaz Yalcin.
Os autores aplicaram um screening de edição genética em escala genômica, desativando sistematicamente cerca de 20 mil genes em células-tronco embrionárias enquanto estas se diferenciavam em neurônios. Ao interromper individualmente a função de cada gene, a equipe mapeou os passos críticos do processo de diferenciação neural e estabeleceu uma lista de 331 genes essenciais para a geração de neurônios — muitos deles sem associação prévia conhecida com a neurogênese.
Essa abordagem funciona como uma espécie de varredura do “planta da cidade” do cérebro em formação: ao tirar um componente de cada vez, torna-se possível ver quais alicerces genéticos fazem o sistema nervoso emergente desabar. Para além da catalogação, os autores vinculam essas descobertas à compreensão das bases genéticas de condições do neurodesenvolvimento, incluindo variações no tamanho cerebral, autismo e atraso do desenvolvimento.
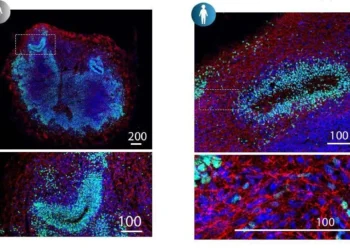
Entre os achados de maior impacto está a identificação do PEDS1 como crucial para a produção de plasmalogênios, uma classe especializada de fosfolipídios presente em membranas ricas em mielina, a bainha isolante das fibras nervosas. A perda de função do PEDS1 demonstrou reduzir o tamanho do cérebro nos modelos estudados, sugerindo que sua deficiência pode comprometer o desenvolvimento humano.
Para validar a relevância clínica, os pesquisadores realizaram testes genéticos em duas famílias não aparentadas e encontraram uma mutação rara no PEDS1 associada a um quadro severo de atraso do desenvolvimento e microcefalia em duas crianças. Esses resultados fortalecem a hipótese de que alterações em vias metabólicas de lipídios de membrana têm impacto direto na arquitetura e na função do cérebro em desenvolvimento.
“Monitorando a diferenciação de células-tronco embrionárias em células neurais e inativando quase todos os genes do genoma, criamos um mapa dos genes essenciais para o desenvolvimento cerebral”, afirma Shifman. Segundo o grupo, essa mapa genético pode aprimorar o diagnóstico molecular de distúrbios do neurodesenvolvimento e servir como base para pesquisas futuras sobre prevenção e intervenções terapêuticas.
Do ponto de vista da infraestrutura biológica e da política científica, o trabalho representa um avanço metodológico: a combinação de CRISPR em escala genômica com modelos celulares humanos traduz o fluxo de dados genéticos em um diagrama funcional dos processos de diferenciação neuronal. Essa camada de inteligência biológica — assim como o sistema nervoso de uma cidade depende de linhas elétricas e estações de distribuição — permite identificar pontos de falha que antes eram invisíveis.
Em termos práticos para a Europa e para a Itália, o estudo abre caminhos para uma triagem genética mais precisa em crianças com suspeita de transtornos do desenvolvimento e enfatiza a importância de integrar dados de lipidômica e genômica para entender patologias associadas à mielinização. A descoberta do papel do PEDS1 e dos plasmalogênios ilustra como pequenas alterações bioquímicas na “camada” das membranas celulares podem repercutir na escala macro da anatomia cerebral.
Conclui-se que, ao mapear os alicerces genéticos do desenvolvimento neural, pesquisas como esta não apenas expandem o catálogo de genes relevantes, mas também fornecem um roteiro operacional para diagnóstico e investigação clínica — um passo pragmático rumo à tradução das descobertas genômicas em cuidados médicos mais precisos.