Reprogramação direta cria neurônios que regulam a atividade cerebral
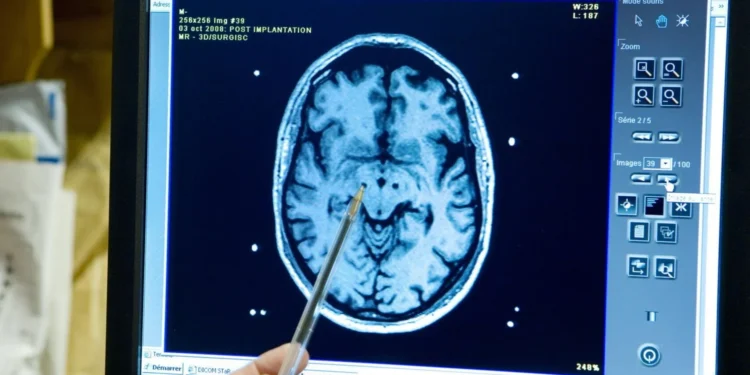
Pesquisadores da Universidade de Lund desenvolveram em laboratório um método capaz de transformar células gliais humanas — as células de suporte do sistema nervoso — em neurônios parvalbumínicos, um tipo celular crucial para manter o cérebro em equilíbrio e evitar episódios de hiperatividade neuronal. O trabalho, publicado na revista Science Advances, representa um avanço prático para a investigação de doenças neurológicas e psquiátricas como esquizofrenia e epilepsia.
Os neurônios parvalbumínicos atuam como elementos estabilizadores das redes neurais: regulam a sincronização dos circuitos e preservam o ritmo elétrico cerebral. Quando sua função ou número é comprometido, a arquitetura funcional do cérebro pode perder estabilidade, favorecendo os quadros clínicos associados a déficits cognitivos e crises convulsivas. Produzir esses neurônios em laboratório sempre foi um desafio, porque eles emergem tardiamente durante o desenvolvimento fetal e resistem às estratégias convencionais de diferenciação celular.
O grupo comandado por Daniella Rylander Ottosson descreve uma reprogramação direta que evita a etapa intermediária das células-tronco. Em vez de voltar a uma identidade indiferenciada, as células gliais foram convertidas mais rapidamente ao ativar diretamente um conjunto de genes-chave que determinam a identidade dos neurônios parvalbumínicos. Esse atalho molecular diminui o tempo necessário e aumenta a fidelidade das células geradas em relação aos equivalentes naturais.
Do ponto de vista experimental, a técnica abre duas frentes imediatas de impacto. No curto prazo, permitirá modelar em laboratório os mecanismos celulares subjacentes a condições como esquizofrenia e epilepsia usando material derivado de pacientes, possibilitando análises mais acuradas do que acontece nas camadas de rede do cérebro afetado. Em perspectiva de médio prazo, a descoberta sugere caminhos para terapias regenerativas que, um dia, poderiam substituir neurônios danificados diretamente no tecido neural.
Como analista que olha para tecnologia e infraestrutura biológica como camadas integradas, vejo essa conquista como a construção de um componente crítico na «infraestrutura do sistema nervoso». A capacidade de reconstituir unidades de controle — os neurônios parvalbumínicos — equivale a reparar um nó mal-funcionante numa rede elétrica: o fio de tensão que estabiliza o fluxo foi restaurado. Ainda assim, a transposição desse resultado para terapias in vivo exige passos laboratoriais e regulatórios substanciais, testes de segurança e integração funcional em circuitos já estabelecidos.
Os autores identificaram genes reguladores centrais nessa transição de identidade celular, apontando alavancas moleculares que podem ser afinadas para melhorar eficiência e segurança. Em termos práticos, isso significa que a pesquisa não apenas descreve uma conversão possível, mas oferece um mapa de quali- e quantos ajustes são necessários para transformar a descoberta em ferramenta científica e, potencialmente, clínica.
Em suma, o estudo de Lund configura-se como um avanço metodológico importante: fornece material humano de alta fidelidade para estudar distúrbios onde a perda de controle da excitabilidade é central, e lança as bases para futuras intervenções regenerativas que poderiam restaurar o equilíbrio das redes neurais. É um passo pragmático na engenharia fina do tecido neural — um ajuste de rede que pode, no futuro, reduzir crises e recuperar funções perdidas.